Question 1: 理想气体状态方程 $\mathrm { pV } = \mathrm { nRT }$ 是描述理想the substance of gas的量and其体积、分压、温度间关系的状态方程。其中摩尔气体常数...
理想气体状态方程 $\mathrm { pV } = \mathrm { nRT }$ 是描述理想the substance of gas的量and其体积、分压、温度间关系的状态方程。其中摩尔气体常数 $R$ 可通过如图所示实验装置测定,实验过程中,将铝片打磨后称量,再用铜丝缠绕并放在反应管口,向反应管内加入足量稀硫酸。读取量气管的起始读数后,移动反应管,使铝片滑入稀硫酸中。下列说法不正确的是( ) 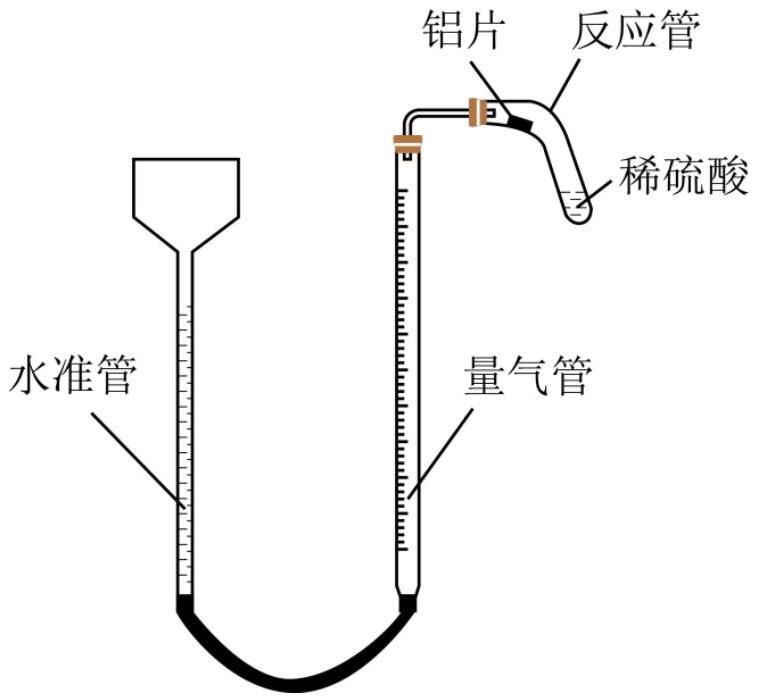
- A. A. 简易量气装置的量气管可用碱式滴定管代替
- B. B. 用铜丝缠绕铝片的目的是加快反应速率
- C. C. 不可用稀硝酸代替稀硫酸
- D. D. 待反应管内溶液无明显气泡产生后,应立that is对量气管进行读数
Answer: D